|
Nucleótido em adenina -> nucleótido em
guanina
Gene - sequência
de nucleótidos que contém a informação para a construção de
uma dada proteína.
Nucleótido - unidade estrutural dos ácidos
nucleicos.
Aminoácido - unidade
estrutural das proteínas. |
|
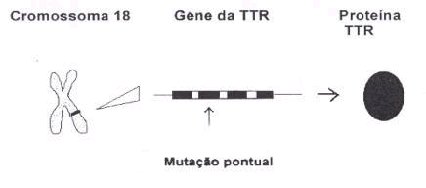
As fibras de
amilóide resultam duma alteração (mutação) no braço longo do
cromossoma 18 do gene que codifica a transtirretina (TTR).
A substituição neste gene de um único nucleótido em
adenina por um em guanina (bases constituintes dos
nucleótidos), na posição 30, leva a que seja codificado o
aminoácido metionina (Met) em vez de valina, o que vai
originar uma proteína com características diferentes.
Como é dominante, se os indivíduos forem
homozigotas (tiverem os dois elementos do par do cromossoma 18
com a mutação) têm 100% de probabilidade de transmitir a
doença aos seus descendentes. Se forem heterozigotas (só um
dos cromossomas afectado) a probabilidade desce para 50%. O
facto de um indivíduo ser homo ou heterozigota parece não
agravar a sintomatologia, havendo até casos de homozigotas
assintomáticos.
|
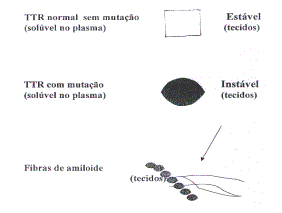 |
Enquanto a TTR normal é solúvel no plasma e
estável nos tecidos, a mutada é solúvel no plasma mas instável
nos tecidos, polimerizando (agregando) e formando fibras de
amilóide.
|
|
As fibras, ao serem
observadas ao microscópio de luz polarizada, aparecem
esverdeadas, devido à dupla refracção da luz
incidente.
|
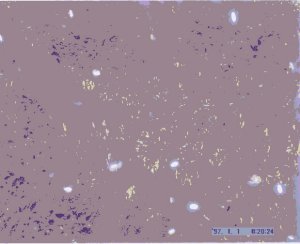 |
Deposição de substância amilóide num tecido de PAF
observada ao microscópio de luz polarizada
(Unidade de
Amilóide, IBMC, Rui Fernandes) |
|
Como existem outras proteínas com
capacidade de polimerizar, quando os investigadores observam
depósitos de amilóide em tecidos, para terem a certeza que se
trata de TTR, coram-nos com anticorpos específicos dessa
proteína obtidos após injecção de TTR num animal que a
reconheça como proteína diferente.
|
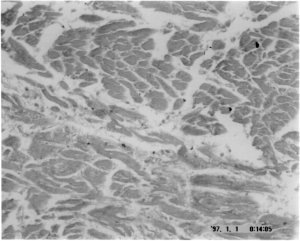 |
Localização de depósitos da TTR no tecido muscular
corados com anticorpos.
(Unidade de Amilóide, IBMC, Rui
Fernandes) |
|
A TTR é uma
proteína tetrâmera (constituída por quatro subunidades),
relacionada com o transporte da RBP (proteína de ligação da
vitamina A), de lípidos e da tiroxina (hormona da tiróide). Se
o indivíduo for homozigota, tem as quatro subunidades mutadas,
se for heterozigota poderá ter uma, duas ou três. No entanto,
se o mecanismo de deposição das fibras for o mesmo, o que
ainda se está a investigar, tanto faz ser homo ou
heterozigota.
Existem outras mutações na TTR, algumas
das quais não patogénicas, que estão associadas à Met 30. No
nosso país, foram identificadas seis famílias com a dupla
mutação (Met 30 e Met 119), verificando-se que a doença
aparece mais tardiamente e a sua evolução é menos acentuada. A
protecção que a segunda mutação (Met 119) faz da
sintomatologia clínica está relacionada, segundo Maria João
Saraiva, com o facto de, para se formarem fibras, haver
necessidade da TTR se dissociar nas suas quatro subunidades.
Como a Met 30 o faz muito facilmente e a Met 119 oferece
grande resistência a essa dissociação, a associação das duas
atenua a sintomatologia.
|
|